|
Лечение псилоцибином продлевает жизнь клеток
|
| Псилоцибин, природное психоделическое соединение, вырабатываемое галлюциногенными грибами, привлекло к себе внимание благодаря значительным клиническим доказательствам его терапевтического потенциала для лечения различных психиатрических и нейродегенеративных заболеваний. Однако лежащие в основе этого молекулярные механизмы остаются загадочными, и лишь немногие исследования изучали их системное воздействие. Мы предоставляем первые экспериментальные доказательства того, что лечение псилоцибином (активным метаболитом псилоцибина) продлевает продолжительность жизни клеток, а лечение псилоцибином способствует увеличению продолжительности жизни пожилых мышей, что позволяет предположить, что псилоцибин может быть мощным геропротекторным средством. |
| Вступление |
| На сегодняшний день завершено или продолжается более 150 клинических исследований с применением псилоцибина по различным клиническим показаниям, включая психиатрические (тревога, депрессия, зависимость), нейродегенеративные (болезнь Альцгеймера), болевые ощущения и многое другое 1,2,3. Исследования на людях показали, что однократная доза псилоцибина может облегчить изнурительные физические и психологические симптомы - с длительным эффектом (до 5 лет)4,5. Несмотря на значительные клинические данные, подтверждающие терапевтическую пользу псилоцибина, молекулярные механизмы, ответственные за это воздействие, остаются загадочными. Исследования с применением псилоцибина были в основном сосредоточены на неврологических воздействиях и/или поведенческих последствиях; лишь в немногих исследованиях оценивались альтернативные или системные механизмы, которые также могут способствовать его благотворному воздействию. |
|
| “Гипотеза псилоцибина и теломер”6 постулирует, что воздействие псилоцибина может количественно влиять на длину теломер, что может служить потенциальным объяснением его эффективности при широком спектре клинических показаний. Эта гипотеза основана на большом количестве исследований, связывающих биологические маркеры старения психического здоровья6. Накапливающиеся данные свидетельствуют о том, что клиническая депрессия ускоряет старение и укорачивает теломеры 7,8,9. Положительные психические состояния связаны с удлинением теломер, в то время как негативные психологические состояния (например, хронический стресс, тревога и депрессия) связаны с истощением теломер 7,10,11,12,13. Учитывая клинические данные, подтверждающие эффективность псилоцибина при этих состояниях, вполне вероятно, что псилоцибин может влиять на длину теломер. Однако ни в одном из предыдущих исследований не проводилось экспериментального изучения прямого воздействия псилоцибина на биологическое старение. |
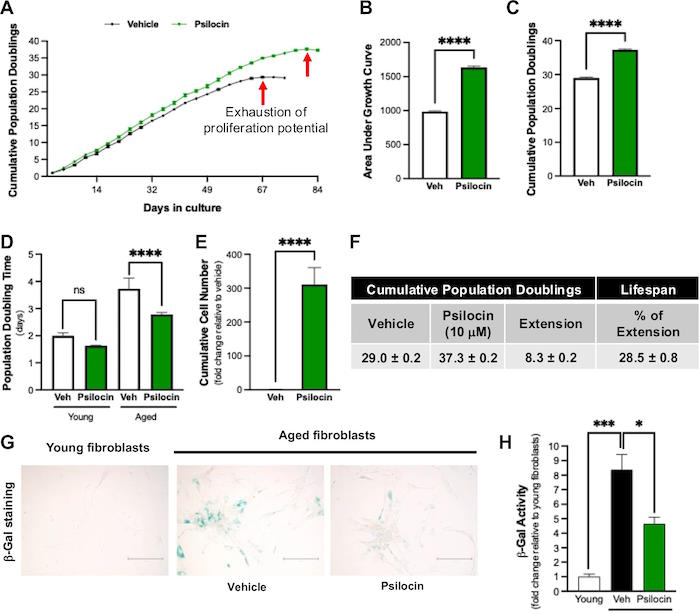
| Чтобы оценить влияние псилоцибина на клеточное старение, мы использовали проверенную модель репликативного старения с использованием фибробластов легких плода человека14. Для всех исследований in vitro мы использовали псилоцин (активный метаболит псилоцибина), который образуется при расщеплении псилоцибина после приема внутрь. Клетки последовательно пассировали в среде, содержащей псилоцин или носитель, до тех пор, пока они не достигали репликативного старения. Обработка псилоцином (10 мкм) привела к увеличению продолжительности жизни клеток на 29%, что характеризовалось замедленным истощением пролиферативного потенциала, увеличением суммарного удвоения популяции и уменьшением времени удвоения популяции по сравнению с носителем (рис. 1А–F). Результаты были более впечатляющими при использовании более высокой дозы псилоцина в клетках того же типа (обработка 100 мкм привела к увеличению продолжительности жизни клеток на 57%; Дополнительный рисунок. 1A–F). Индукция старения происходила как в клетках-носителях, так и в клетках, обработанных псилоцином, поскольку обе группы достигли истощения своего пролиферативного потенциала (признаков онкогенной трансформации не наблюдалось), однако в клетках, обработанных псилоцином, начало старения было отложено (рис. 1А). Кроме того, по сравнению с носителем, обработанные псилоцином клетки демонстрировали пониженную активность ?gal (рис. 1G–H). Эти результаты соответствовали дозозависимому снижению уровня маркеров остановки клеточного цикла (p21, p16) и увеличению уровня маркеров пролиферации (PCNA) и репликации ДНК (pRB) (рис. 1I). По сравнению с носителем, лечение псилоцином также приводило к повышению уровня сиртуина 1 (SIRT1; играет важную роль в регуляции клеточного старения, метаболизма и реакций на стресс) и уменьшению задержки роста и уровня 45 альфа (GADD45a), вызывающего повреждение ДНК, что свидетельствует о снижении повреждения ДНК (рис. 1I). Лечение псилоцином также снижало уровни окислительного стресса в зависимости от дозы (рис. 1J), что было связано со снижением уровня NADPH-оксидазы-4 (Nox4, главного регулятора выработки окислителей) и повышением уровня связанного с ядерным эритроидным фактором 2 фактора 2 (Nrf2, главного регулятора антиоксидантных реакций). (Рис. 1I). В целом, эти результаты свидетельствуют о том, что воздействие псилоцина in vitro зависит от дозы, и более высокая доза в конечном итоге приводит к большему продлению жизни клеток. Для дальнейшего подтверждения этих результатов мы повторили эти исследования с клетками другого типа (фибробласты кожи взрослого человека); обработка псилоцином в дозе 100 мкм увеличила продолжительность жизни клеток на 51%, что сопровождалось уменьшением старения и снижением уровня окислительного стресса (дополнительный рис. 2). Чтобы исследовать другие потенциальные механизмы, с помощью которых псилоцин способствует увеличению продолжительности жизни, мы также оценили его влияние на длину теломер (уменьшение длины теломер является признаком старения клеток). Как и ожидалось, стареющие клетки, обработанные носителем, показали уменьшение длины теломер по сравнению с молодыми контрольными клетками (рис. 1К). Напротив, длина теломер была сохранена в клетках, обработанных псилоцином, соответствующих возрасту (рис. 1К). Таким образом, эти данные свидетельствуют о том, что псилоцин воздействует на сигнальные пути, связанные со старением клеток, что в конечном итоге задерживает начало старения и увеличивает продолжительность жизни клеток. |
| Чтобы оценить влияние псилоцибина на продолжительность жизни in vivo, самок мышей в возрасте 19 месяцев обрабатывали носителем или псилоцибином один раз в месяц в течение 10 месяцев (фиг. 2А); мышам первоначально вводили низкую дозу (5 мг/кг) для первой обработки, после чего ежемесячно вводили высокие дозы (15 мг/кг) в общей сложности в течение 10 процедур. Мы решили использовать 19-месячных мышей, что примерно эквивалентно 60-65 человеческим годам, чтобы оценить его терапевтический потенциал в качестве клинически значимого средства против старения. В течение 30 минут после лечения мыши демонстрировали повышенную реакцию на подергивание головой (данные не приведены), что является хорошо известным поведенческим показателем галлюциногенного воздействия псилоцибина на мышей15. Как в группах, получавших псилоцибин, так и на носителе, наблюдалась некоторая потеря массы тела от начала до конца протокола лечения, однако потеря веса у мышей, получавших носитель, по сравнению с мышами, получавшими псилоцибин, существенно не отличалась (дополнительный рис. 3). Примечательно, что мыши, получавшие псилоцибин, продемонстрировали значительно более высокую выживаемость (80%) по сравнению с носителем (50%) (рис. 2Б). Хотя количественно это не измерялось, у мышей, получавших псилоцибин, наблюдалось фенотипическое улучшение общего качества шерсти, включая рост шерсти и уменьшение седины по сравнению с мышами, получавшими носитель (рис. 2С). Подводя итог, мы приводим первые экспериментальные данные, демонстрирующие, что лечение псилоцибином может повысить выживаемость пожилых мышей. |
| Псилоцибин является мощным серотонинергическим агонистом, который взаимодействует с серотониновым рецептором (5-НТ2А) и другими подтипами 5-НТ рецепторов. Примечательно, что рецептор 5-HT2A экспрессируется во многих органах и типах клеток (включая фибробласты, нейроны, кардиомиоциты, эндотелий, эпителий, макрофаги и Т-клетки)16. Недавнее исследование показало, что стимуляция 5-HT2A в нейронах коры головного мозга индуцирует SIRT1-зависимую экспрессию антиоксидантных ферментов, что приводит к снижению окислительного стресса и нейропротекции 17. SIRT1 является ключевым регулятором старения, и было показано, что избыточная экспрессия SIRT1 увеличивает продолжительность жизни организма у C. elegans и мышей18. Здесь мы демонстрируем, что псилоцин увеличивает экспрессию SIRT1 в клетках, что указывает на потенциальный механизм, с помощью которого псилоцибин задерживает старение и способствует долголетию. Это исследование предоставляет первые экспериментальные данные, свидетельствующие о том, что псилоцибин может влиять на множество признаков старения, включая замедленное старение, сохранение длины теломер, повышение стабильности ДНК (за счет усиления реакций на повреждение ДНК, таких как GADD45a), и/или может уменьшать аберрантные межклеточные связи (за счет снижения окислительного стресса и последующей передачи сигналов). Необходимы дальнейшие исследования для дальнейшего изучения воздействия псилоцибина на возрастные пути и молекулярные механизмы, ответственные за его системные эффекты (включая 5-НТ-зависимые и/или независимые механизмы). Предыдущие исследования показали, что длительное воздействие психоделических препаратов может быть обусловлено эпигеномными изменениями, включая ремоделирование хроматина и метилирование ДНК 19,20,21. Возможно, что псилоцибин также может опосредовать эпигенетические изменения, которые способствуют наблюдаемым геропротекторным эффектам; такие исследования заслуживают изучения. Однако нормативные барьеры, связанные с его включением в список I, наряду с ограниченной доступностью федерального финансирования исследований псилоцибина, остаются существенными препятствиями, которые препятствуют прогрессу исследований 22,23; таким образом, механизмы, лежащие в основе его потенциальных терапевтических преимуществ, остаются недостаточно изученными. |
| Наше исследование предоставляет первые экспериментальные доказательства того, что псилоцибин влияет на признаки старения, подтверждая ранее предложенную “гипотезу псилоцибин-теломер”6. Мы демонстрируем, что лечение псилоцибином продлевает продолжительность жизни как клеток, так и животных (даже если лечение начинают в позднем возрасте). Эффективное омолаживающее средство, которое можно было бы применять у взрослых в пожилом возрасте, может иметь значительный клинический потенциал. Доза, используемая на мышах, была смоделирована на основе клинического исследования с участием пациентов в возрасте от 29 до 70 лет (трое пациентов были старше 65 лет), в ходе которого не было зарегистрировано серьезных нежелательных явлений в конечной точке исследования или в период наблюдения после исследования (98 дней)24; Эти данные подтверждают целесообразность применения лечение псилоцибином пожилых людей. Кроме того, определение псилоцибина Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов как “прорывной терапии” подчеркивает его безопасность, поскольку сообщалось о минимальных побочных эффектах25,26,27,28. Однако необходимы дополнительные исследования для определения оптимальных протоколов с точки зрения терапевтической эффективности, включая возраст начала лечения, частоту и дозы процедур, а также для определения того, влияет ли лечение на максимальную продолжительность жизни. Даст ли более раннее вмешательство больший терапевтический эффект и/или существует ли порог в пожилом возрасте, за которым псилоцибин перестает быть эффективным? Хотя в некоторых исследованиях сообщалось о специфических для пола эффектах псилоцибина у грызунов, существующая литература содержит ограниченные и противоречивые данные о фармакодинамических различиях, обусловленных полом29,30,31. Соответственно, мы использовали однополый дизайн, чтобы свести к минимуму возможные смешивающие факторы, связанные с биологическими различиями по признаку пола, и обеспечить воспроизводимость в этом первоначальном исследовании in vivo. Необходимы будущие исследования для оценки терапевтических и механических эффектов псилоцибина в зависимости от пола. Наши исследования in vitro показывают, что увеличение продолжительности жизни клеток, опосредованное псилоцином, не приводит к онкогенной трансформации, поскольку обработанные псилоцином клетки действительно достигают репликативного старения и истощения пролиферативного потенциала. Однако можно утверждать, что замедленное истощение пролиферативного потенциала и/или старение могут повлиять на онкогенез или прогрессирование рака. Будущие исследования должны тщательно оценить потенциальное воздействие длительного лечения псилоцибином in vivo на заболеваемость раком и/или его прогрессирование. В нескольких исследованиях оценивались последствия длительного приема препарата. |
| Помимо неврологических и психологических преимуществ, полученные нами данные свидетельствуют о том, что псилоцибин влияет на системные процессы старения, что потенциально объясняет его длительный терапевтический эффект при различных заболеваниях. Хотя влияние псилоцибина на периферические органы остается в значительной степени неизученным, эти исследования указывают на неиспользованный терапевтический потенциал системного воздействия псилоцибина. Псилоцибин может представлять собой “разрушительную” фармакотерапию в качестве нового геропротекторного средства, способствующего здоровому старению и/или потенциальному терапевтическому вмешательству при возрастных заболеваниях. |
| Методы |
| Реактивы |
| Псилоцибин (каталожный номер 14041) и псилоцин (каталожный номер 11864) были получены компанией Cayman Chemical (Анн-Арбор, Мичиган) по лицензии DEA. Мы приобрели следующие антитела: GAPDH, RB, фосфор-RB (клеточная сигнализация); Nox4, PCNA, p53, p21 и бета-актин (Abcam); p16 (BD Biosciences); Вторичные антитела к пероксидазе хрена (HRP), конъюгированные с мышиными и кроличьими антителами (Bio-Рад). Мы приобрели коктейль из ингибиторов протеазы и фосфатазы Halt (ThermoFisher Scientific). Все остальные химические вещества/реагенты были приобретены (Sigma), если не указано иное. |
| Исследования на животных |
| Взрослые (19-месячные) самки мышей C57BL/6J были получены из лаборатории Джексона и акклиматизированы в ветеринарном учреждении в течение одного месяца до начала исследования. Затем мышей случайным образом распределили на контрольную и лечебную группы, чтобы обеспечить сбалансированное распределение по группам, включая сопоставимую среднюю массу тела в разных группах. Обоснование используемого режима дозирования было основано на ряде факторов. Во-первых, мы попытались смоделировать высокие дозы, использованные в клиническом исследовании хронической боли, когда пациентам вводили психоделическую дозу (25 мг) псилоцибина24. Используя стандартный метод аллометрического масштабирования32, доза псилоцибина для человека в 25 мг соответствует дозе для мыши в 5,14 мг/кг; это послужило отправной точкой для определения дозы. Однако мыши демонстрируют значительно более быстрый метаболический профиль псилоцибина по сравнению с людьми, что приводит к более короткому периоду полувыведения и более быстрому системному выведению псилоцина; период полувыведения псилоцина составляет 0,9 ч у мышей33 против 1,8-3 ч у человеков34. В связи с таким быстрым клиренсом у мышей была выбрана более высокая доза - 15 мг/кг, чтобы обеспечить достаточное системное воздействие, сравнимое с теми, которые наблюдались в клинических испытаниях на людях. Также важно отметить, что токсикологические исследования показывают, что псилоцибин хорошо переносится мышами в дозах до 180-250 мг/кг35, что значительно превышает дозу, использованную в данном исследовании. Мыши получали низкую дозу (5 мг/кг) первоначально для первой обработки, чтобы подготовить мышей к длительному лечению, с последующим ежемесячным введением высокой дозы псилоцибина (15 мг/кг в стерильном физиологическом растворе) или носителя (стерильный физиологический раствор) через оральный зонд (мышам, находящимся в сознании) один раз в месяц (всего 10 процедур) (рис. 2А); все процедуры проводились ежемесячно с 9:00 до 12:00. Мышам вводили препарат в исходной концентрации (4 мг/мл в стерильном физиологическом растворе); мышей взвешивали в каждый день лечения и вводили объем зонда в диапазоне от 100 до 200 мкл (общий объем) в зависимости от их веса на момент лечения. Всех мышей умерщвляли, как только смертность в любой группе достигала 50%, что означало окончание исследования в соответствии с протоколом IACUC. Мышей подвергали эвтаназии путем вдыхания CO2 с последующим применением вторичного метода для обеспечения смерти в соответствии с руководящими принципами Американской ассоциации ветеринарной медицины (AVMA) по эвтаназии животных и утвержденными протоколами IACUC. На протяжении всего эксперимента за мышами наблюдали по массе тела и признакам заболеваемости. Мышам давали стандартную пищу в неограниченном количестве и содержали в режиме "свет/темнота" в течение 12:12 часов. Исследователи не были слепы к распределению групп во время экспериментальных процедур или анализа данных из-за логистических ограничений, включая нормативные акты и протоколы безопасности, связанные с обращением с псилоцибином, веществом, входящим в список I, а также из-за исследовательского характера исследования. Все эксперименты и процедуры с участием животных проводились в соответствии с правилами содержания и эксплуатации животных в специальных учреждениях (IACUC) Руководящие принципы Комитета Университета Эмори (PROTO202000138). |
| Определение длины теломер |
| Геномная ДНК была выделена из клеток с помощью набора QIAwave DNA Blood & Tissue kit (QIAGEN). Количественную ОТ-ПЦР проводили с геномной ДНК с использованием праймеров, разработанных против последовательности теломер человека или эталонного гена в одной копии (Human kit, ScienCell, каталог №8918). Набор праймеров single copy reference (SCR) распознает и амплифицирует область длиной 100 п.н. на хромосоме 17 человека, которая служит эталоном для нормализации данных; Кривые амплификации сравнивались с эталонным контролем с известной длиной теломер. |
| Культивирование клеток |
| Были приобретены фибробласты легких плода человека (IMR-90) (хранилища клеток Кориелла) и фибробласты кожи взрослого человека (ATCC). Клетки IMR-90 культивировали в DMEM с добавлением 10% фетальной бычьей сыворотки (FBS), 100 ед/мл пенициллина, 100 мкг/мл стрептомицина. Фибробласты кожи культивировали в базальной среде для фибробластов с добавлением 2% FBS, L-глютамина (7,5 мм), FGF (5 нг/мл), инсулина (5 мкг/мл), гидрокортизона (1 мкг/мл) и аскорбиновой кислоты (50 мкг/мл). Все клетки были приобретены на 7-8 пассажах и размножены в течение 2-3 пассажей перед началом применения протоколов лечения. Псилоцин растворяли в ДМСО (50 мм) для исследований in vitro. |
| Удвоение популяции |
| Клетки высевали с фиксированной плотностью (1 ? 106) и культивировали в колбе Т75. Клетки подсчитывали с помощью счетчика клеток TC20 (Bio-rad), пассировали каждые 3-4 дня и повторно высевали (1 ? 106) в течение всего эксперимента (до тех пор, пока клетки не достигали репликативного старения). Было рассчитано число удвоений популяции (PD). Мы количественно оценили различия между обработкой псилоцином и носителем, используя площадь под кривой роста (AUC), как показатель влияния лечения на удвоение клеток.36,37 |
| Анализы старения |
| Мы использовали субстрат бета-галактозидазы для количественной оценки клеточного старения (ThermoFisher Scientific) в соответствии с инструкциями производителя. Мы также использовали набор для определения старения, предназначенный для гистохимического определения активности бета-gal в культивируемых клетках (Abcam). |
| Вестерн-иммуноблоттинг |
| Мы подготовили клеточные лизаты в буфере RIPA с использованием протеазы Halt и ингибитора фосфатазы, подвергли их обработке SDS-PAGE в восстановительных условиях и провели вестерн-иммуноблоттинг, как описано ранее. Количественный анализ лизатов проводили с использованием набора для анализа белка Micro BCA (Pierce) в соответствии с инструкциями. Мы использовали ECL-субстрат для вестерн-блоттинга (Azure biosystems) и системы визуализации Azure C400 (Azure biosystems) для выявления специфических иммунореактивных сигналов. |
| Определение активных форм кислорода (АФК) |
| Содержание перекиси водорода (H2O2) в клетках оценивали с помощью набора для анализа Amplex Red (ThermoFisher Scientific). Интенсивность флуоресценции измеряли при 550 нм для возбуждения и испускания в диапазоне 590 нм с помощью планшетного считывателя Synergy H1 (BioTek). |
| Статистический анализ |
| Были сгенерированы графики и проведен статистический анализ с помощью программного обеспечения GraphPad Prism версии 10.4.1 (532), Бостон, Массачусетс, США. Для всех экспериментов с культивированием клеток (рис. 1) уровни удвоения популяции были рассчитаны на основе прямого подсчета клеток, выполненного в четырех технических повторностях при каждом прохождении. Эти значения повторности были использованы для вычисления среднего стандартного отклонения (SD) для каждого временного интервала. Данные других анализов, включая активность бета-галактозидазы, выработку АФК и длину теломер, были проанализированы с использованием 3-5 технических повторов для каждой группы, как указано в подписях к рисункам. Статистические сравнения были выполнены с использованием двухсторонних непарных t-тестов с неравной дисперсией или, при необходимости, двухстороннего дисперсионного анализа ANOVA. Для исследования выживаемости животных (рис. 2) кривые выживаемости были проанализированы с использованием логарифмического критерия Мантела–Кокса. Для обеспечения единообразного анализа конечной точки выживаемости все мыши были умерщвлены через 10 месяцев после первоначального лечения, когда в первой группе была достигнута медиана выживаемости. Статистически значимым считалось значение p менее 0,05. Полная информация о статистических тестах, количестве повторов (n) и пороговых значениях значимости приведена в подписи к рисунку. |
| Источник |